Científicamente, diremos que es la representación del modelo atómico de Schrödinger o modelo de la mecánica cuántica. Configurar significa "ordenar" o "acomodar", y electrónico deriva de "electrón"; así, configuración electrónica es la manera ordenada de repartir los electrones en los niveles y subniveles de energía.
Consiste en la distribución de los electrones en los diferentes orbitales de un átomo, y para desarrollarla se aplica la Regla de las Diagonales: Se toman las flechas de arriba hacia abajo y del extremo superior a la punta, una tras otra. Así que en cada orbital, se deberán llenar con 2 electrones máximo ( Primero el orbital 1s= 2e-; después 2s= con 2e-; después el 2p= 6e- <aquí recordemos que el subnivel p tiene 3 elipces, cada una se llena con 2e->y así sucesivamente hasta llegar a los subniveles u orbitales d con 10e- <debido a que contiene 5 elipses > y los subniveles f con 14 e- <pues tiene 7 elipces>; realizaremos este llenado hasta que completemos el número de electrones que contiene el átomo).
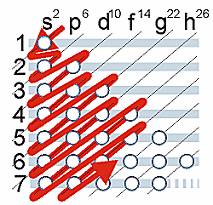
Los elementos tendrán una terminación en su configuración electrónica de acuerdo a su posición en la tabla periódica. El último nivel de la configuración electrónica coincide con los periodos del elemento considerado siempre y cuando esté en los bloques “s” o “p”; mientras que en el “d” se resta una unidad y en el “f ” se le restan 2 unidades al periodo correspondiente.
No hay comentarios:
Publicar un comentario